|
Getting your Trinity Audio player ready…
|
Por Aline Rockenzahn
Estudiante de Ingeniería en Nanotecnología
La nanotecnología ha brindado una propuesta capaz de revolucionar el área médica: la observación de un fenómeno óptico que ocurre al enviar luz a un ángulo específico sobre una nanoestructura puede detectar, e incluso predecir, la aparición del cáncer de mama. Este texto, presentado en formato de diario de campo, busca contar la experiencia del proyecto desde la perspectiva de una estudiante que participa en esta investigación.
Un comienzo fuera de lo normal
Se suele pensar que las grandes historias empiezan con motivaciones igual de grandes, pero la mía empezó por la curiosidad. Al inicio de mi carrera como ingeniera en nanotecnología, escuché a profesor Edgar Briones del Departamento de Matemáticas y Física del ITESO, hablar sobre las aplicaciones de las nanoestructuras que estábamos aprendiendo a fabricar durante un taller de laboratorio. Supuestamente, incluso podían combatir el cáncer, y no me lo creí.
Días después, le pedí al profesor si me podía explicar más acerca del tema. Me respondió con una idea ambiciosa para estos materiales: crear un sensor capaz de hacer lo que ningún otro método de diagnóstico actual ha podido con el cáncer de mama. Es decir, detectarlo y atacarlo antes de que aparezca algún síntoma.

Situación actual de la detección del cáncer de mama
El cáncer de mama es el más común en mujeres y la segunda causa de muerte por cáncer. La gravedad de la situación radica en lo difícil que resulta un diagnóstico temprano. La mayoría de los métodos se enfocan en la detección de tejido tumoral formado, son extremadamente costosos, aplicables solo a ciertos rangos de edad o utilizan dosis de radiación que, a la larga, ponen en riesgo al paciente.
Decidí compartir el contexto de la enfermedad y la propuesta de solución en un concurso de la carrera llamado Simply Nano. Quería explicarles a otros esta situación que se me hacía tan interesante y presentar la idea innovadora como solución, con un lenguaje tan simple que incluso niños o gente externa a la carrera pudieran entenderlo. Tal parece que al público le gustó el sensor tanto como a mí, y terminé ganando el concurso.
La creatividad es más importante que el conocimiento
Debido a esto, me invitaron a participar formalmente en el desarrollo del sensor. Los semestres de la carrera me habían brindado el conocimiento básico necesario para el proyecto, pero había algo para lo que no me había preparado: la libertad de pensar por mi cuenta.
Cualquier estudiante que desee involucrarse en un proyecto de investigación debe entender que en estas iniciativas no hay recetas predefinidas. No son clases, se requiere creatividad para ayudar a pensar y lograr algo que todavía no existe.
Aportaciones significativas al proyecto
Mi participación en el proyecto ha sido un camino de casi dos años, en colaboración con diferentes centros de investigación e instituciones como el ITESO, la IBERO León, la IBERO México y el IPICYT, donde he aprendido teoría y el manejo de equipos de laboratorio. He explicado el proyecto tanto a compañeros como a profesores a través de presentaciones y he aprendido que en este tipo de investigaciones hay que ser paciente y tolerante a la frustración. Los avances son lentos y por lo general los resultados deseados no se obtienen a la primera.

Desde mi rol como estudiante, mi aportación más significativa ha sido proporcionar las pruebas matemáticas necesarias para diseñar el sensor más eficiente posible. Por medio de un programa llamado COMSOL Multiphysics, basado en el método del elemento finito, llevé a cabo simulaciones que podían durar días o incluso semanas. Esto puso a prueba mi paciencia, creatividad y conocimientos en repetidas veces.

Estructura del sensor
La palabra “nanotecnología” puede sonar novedosa y abrumadora, pero pocos se imaginan que este sensor funciona simplemente como un juego de enviar y observar luces. El procedimiento consiste en analizar la saliva del paciente, que contiene un marcador biológico directamente relacionado con la presencia del cáncer de mama.
Para realizar el análisis, se utiliza una geometría especial llamada “configuración de Kretschmann”. Para este sensor se empieza con un prisma circular o triangular como base y al que se le coloca una capa delgada de metal. Estas capas, llamadas “películas delgadas”, se fabrican en los laboratorios del ITESO con equipo especializado. Finalmente, por encima de la capa metálica se coloca la muestra de saliva del paciente a analizar.
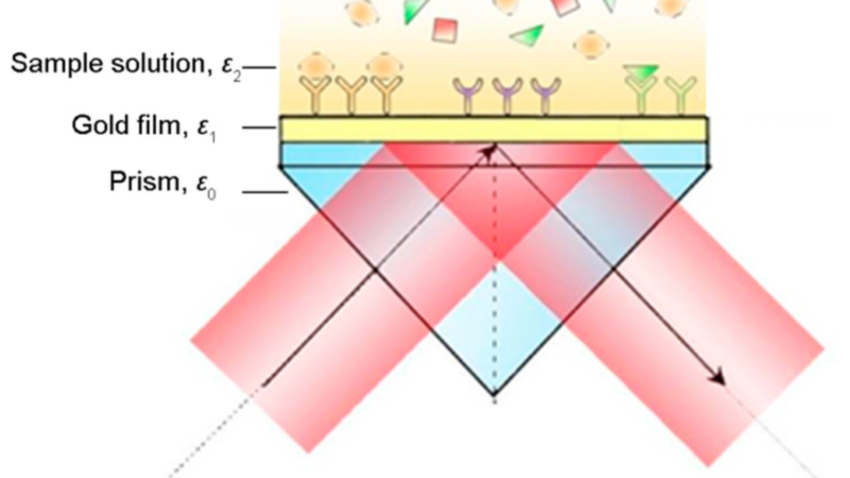
Plasmones de superficie (SPR)
Un plasmón de superficie se crea cuando mandamos un haz de luz (generalmente un láser) a través del prisma hacia la primera capa metálica. En la superficie algunas partículas comienzan a moverse a causa de la luz. Este movimiento genera una onda que viaja de un extremo a otro de la capa. Podemos imaginarla como la “ola” que hacen los espectadores en un estadio, levantando los brazos de un lado a otro de manera coordinada. Esa onda es el plasmón.
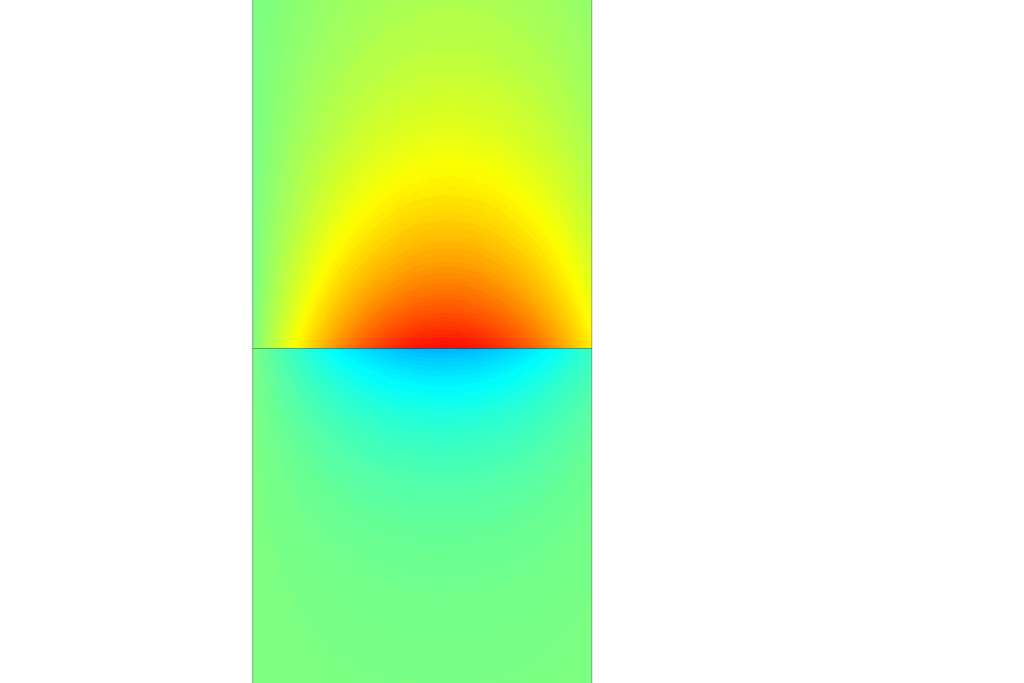
Sin embargo, el plasmón no se genera cada vez que se ilumina el sensor. Dependiendo de la sustancia depositada sobre la estructura y de su cantidad, la onda plasmónica solo aparecerá cuando la luz incida dentro de un rango específico de ángulo, por ejemplo, entre 20 y 30 grados o entre 70 y 78 grados. Este rango debe mantenerse constante para cada medición con el mismo tipo y cantidad de sustancia.
Funcionamiento del sensor y análisis
El rango del plasmón nos interesa porque, en condiciones normales, los materiales del sensor reflejan la luz enviada cuando no hay plasmón. Sin embargo, cuando se genera el plasmón, se produce una disminución visible de la luz reflejada, debido a que el plasmón la absorbe. Dentro de ese rango, habrá un ángulo específico (por ejemplo, entre 50 y 60 grados, el ángulo 54) en el que la absorción de la luz es máxima. Este ángulo se llama “ángulo de resonancia plasmónica de superficie (SPR)” y es nuestra arma estrella para la detección temprana del cáncer de mama.
Un medidor de luz externo registra numéricamente cuando ocurre esta absorción máxima, y nosotros analizamos los datos. Por ejemplo, si en la saliva de un paciente sano el ángulo SPR se sitúa normalmente a 50 grados, este valor debería repetirse en otros pacientes sanos. Si el ángulo SPR se desplaza a otro valor, indica la presencia de cantidades anormales del biomarcador en la saliva, señalando, por lo tanto, cáncer de mama. Además, la magnitud del tamaño del desplazamiento es proporcional al avance de la enfermedad en el paciente.
En la siguiente imagen se muestra el comportamiento óptico de una medición de agua sobre un sensor en configuración de Kretschmann. La curva roja representa la reflectancia (cantidad de luz reflejada). Se observa que el ángulo SPR se encuentra aproximadamente a 74 grados. Este valor fue obtenido a partir de una muestra de agua.

Un método que brilla por su simplicidad
La construcción del sensor puede ser compleja, pero una vez terminado, es fácil apreciar lo simple que es utilizarlo. El método de sensado se resume en depositar la muestra sobre el sensor, mandar luz, registrar el valor del ángulo SPR y compararlo con una referencia de paciente sano. Si el ángulo es diferente, existe una altísima probabilidad de detectar cáncer de mama.

Diferentes estudios y artículos previos, como el de Hernández-Arteaga y otros autores (2019), han demostrado que cierto rango de concentración del biomarcador analizado indica directamente la presencia de cáncer de mama. Una mayor concentración, según estudios de otros autores como Stefenelli (1985), podría señalar la presencia de otros tipos de cáncer, como de útero, pulmón, colon, estómago o próstata. Es decir, el sensor no solo podría predecir el cáncer de mama, sino que en el futuro podría utilizarse para analizar otros tipos de cáncer.

La simplicidad también radica en que no se necesita equipo especializado para el sensado. Como parte del proyecto, se replicó en el ITESO con materiales “caseros”, el proceso que realiza una mesa óptica profesional para medir el plasmón, y se logró observar a simple vista por primera vez en la institución, la disminución de luz provocada por un plasmón de superficie.
El método es barato, rápido, sencillo, no invasivo y sin efectos secundarios. Podría revolucionar el área médica al detectar el cáncer de mama antes de que forme un tumor. Por eso, estoy orgullosa de decir que la nanotecnología nos ha enseñado que, a veces, el método más “pequeño” y simple es el que produce los resultados más grandes.
Para saber más
Hernández-Arteaga, A. C., de Jesús Zermeño-Nava, J., Martínez-Martínez, M. U., Hernández-Cedillo, A., Ojeda-Galván, H. J., José-Yacamán, M., & Navarro-Contreras, H. R. (2019). Determination of salivary sialic acid through nanotechnology: A useful biomarker for the screening of breast cancer. Archives of Medical Research, 50(3), 105–110. https://doi.org/10.1016/j.arcmed.2019.05.013
Singh, Y., Mishra, A. C., Yadav, S., et al. (2025). High-performance plasmonic biosensor for blood cancer detection: Achieving ultrahigh figure-of-merit. Plasmonics, 20, 2083–2091. https://doi.org/10.1007/s11468-024-02429-8
Stefenelli, N., Klotz, H., Engel, A., & Bauer, P. (1985). Serum sialic acid in malignant tumors, bacterial infections, and chronic liver diseases. Journal of Cancer Research and Clinical Oncology, 109, 55–59.